Химические свойства элементов периодической системы
По сути, химические элементы взаимосвязаны между собой характеристиками, свойственными им в состоянии свободного как атома, так и иона, сольватированного или гидратированного, в простом веществе и форме, которую могут образовать их многочисленные соединения. Однако х-кие свойства обычно заключаются в двух явлениях: свойства, характерные для атома в свободном состоянии, и простого вещества. К такому роду свойств относится множество их видов, но самые важные это:
- Атомная ионизация и ее энергия, зависящая от положения элемента в таблице, его порядкового числа.
- Энергетическое родство атома и электрона, которая так же, как и атомная ионизация, зависит от места нахождения элемента в периодической таблице.
- Электроотрицательность атома, не носящая постоянное значение, а способная изменяться в зависимости от различного рода факторов.
- Радиусы атомов и ионов – тут, как правило, используются эмпирические данные, что связано с волновой природой электронов в состоянии движения.
- Атомизация простых веществ – описание возможностей элемента к реакционной способности.
- Степени окисления – формальная характеристика, однако фигурирующая как одна из важнейших характеристик элемента.
- Потенциал окисления для простых веществ – это измерение и показание потенциала вещества к действию его в водных растворах, а также уровень проявления свойств окислительно-восстановительного характера.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
История создания периодической таблицы Менделеева
Настоящая победа пришла в 1869 г., когда немецкий химик Лотар Мейер и великий русский химик Дмитрий Иванович Менделеев открыли принцип построения периодической системы, впоследствии названный также периодическим законом Менделеева.
Прежде всего они расположили все известные элементы по порядку возрастания их атомных весов.
Водород не очень хорошо укладывался в их систему, и они начали с лития и бериллия. Было обнаружено, что если скомплектовать один ряд и разместить под ним второй, то элементы с одинаковыми химическими свойствами оказываются лежащими один под другим, причем это справедливо для всей таблицы.
Li Be В C N O F
Na Mg Al Si Р S Cl
После того как была составлена таблица, выяснилось, что несколько групп элементов никак не укладываются в эти семь категорий. Их удалось включить в таблицу лишь позднее.
Д. И. Менделеев заметил, что при попытке составить вертикальные столбцы из элементов, обладающих одинаковыми свойствами, остается несколько пустых мест. Показанная ниже частная форма периодической таблицы отличается от более поздней, расширенной таблицы.
Li Be В C N O F
Na Mg Al Si P S Cl
К Ca Ti V Cr Mn Fe Co Ni
Си Zn As Se Br
Rb Sr Y Zr Nb Mo
Важнейшим вкладом Менделеева явилось то, что он обнаружил пробелы в периодической таблице и заявил, что эти пустые места должны быть заполнены пока еще не открытыми элементами. Менделеев пошел еще дальше. Он взял на себя смелость предсказать, как будут выглядеть эти, тогда еще не открытые элементы, каковы будут их атомные веса и химические свойства.
Так как он считал, что три не обнаруженных пока элемента должны быть похожи на бор, алюминий и кремний, то он предположительно назвал их соответственно эка-бором, эка-алюминием и эка-кремнием. В частности, эка-кремний, как утверждал Менделеев, должен быть твердым веществом грязно-серого цвета с атомным весом 72 и плотностью 5,5; эка-кремний должен образовывать жидкий хлорид.
Перечисленные элементы никогда раньше никто не предсказывал. И если хотя бы один из этих трех элементов был бы открыт, это навсегда доказало бы значение и мощь системы химических элементов Менделеева.
В оставшиеся три десятилетия XIX столетия в основу расположения элементов клались их относительные веса. Как оказалось впоследствии, более правильно размещать элементы не по атомным весам, а в соответствии с их атомными номерами. Атомный номер элемента представляет собой число положительных электрических зарядов его атомного ядра. Как правило, элементы с большим зарядом имеют и больший атомный вес. Но это не всегда так: например, в случае кобальта и никеля имеет место как раз обратное.
Тот факт, что положительный заряд атома сосредоточен в плотном, чрезвычайно маленьком ядре, был открыт в 1911 г. английским физиком лордом Эрнестом Резерфордом.
В течение двух последующих лет датский физик Нильс Бор детально разработал теорию строения атома и описал орбиты различных групп электронов, вращающихся вокруг ядра.
В 1913 и 1914 гг. английский ученый Генри Мозели дал окончательное определение атомного номера как положительного заряда ядра. С этих новых позиций удалось пересмотреть всю периодическую систему и объяснить некоторые факты, казавшиеся ранее противоречивыми.
ХИМИЯ
§ 5.1. Предпосылки открытия Периодического закона Д. И. Менделеевым
Периодический закон и Периодическая система химических элементов Д. И. Менделеева — основа современной химии. Они относятся к таким научным закономерностям, которые отражают явления, реально существующие в природе, и поэтому никогда не потеряют своего значения.
Их открытие было подготовлено ходом истории развития химии, однако потребовалась гениальность Д. И. Менделеева, его дар научного предвидения, чтобы эти закономерности были сформулированы и графически представлены в виде таблицы. Мы будем пользоваться современными синонимами тех терминов, которые применял великий русский химик.
Ко времени открытия Периодического закона было известно 63 химических элемента, описаны состав и свойства их многочисленных соединений.
Ученые неоднократно предпринимали попытки классифицировать химические элементы, привести сведения о них в систему. К концу 60-х гг. XIX в. насчитывалось более 50 различных вариантов классификации химических элементов (среди них: классификация Берцелиуса на металлы и неметаллы, триады Деберейнера, спираль Шанкуртуа, октавы Ньюлендса, таблица Мейера и др.).
Большинство ученых пытались выявить связь между химическими свойствами элементов и их соединений и атомной массой. Но создать классификацию, включающую все известные в то время химические элементы, не удалось. Ни одна из попыток не привела к созданию системы, отражающей взаимосвязь элементов и выявляющей природу их сходства и различия. Открытие Периодического закона и построение Периодической системы химических элементов — заслуга великого русского ученого Д. И. Менделеева.
В отличие от работ предшественников, предложенная Д. И. Менделеевым таблица Периодической системы химических элементов имела четкую структуру в виде групп и периодов (с рядами), в которой нашлось место не только для всех известных в то время элементов, но были оставлены пустые места для еще не открытых (рис. 8). Система Д. И. Менделеева позволила не только предсказать существование неизвестных элементов, но и предугадать их свойства, исправить неверно определенные атомные массы уже известных элементов.
Рис. 8. Первоначальный вариант Периодической системы, воспроизведенный на здании в Санкт-Петербурге, где работал Д. И. Менделеев
Третьей предпосылкой открытия Периодического закона послужили решения международного съезда химиков в г. Карлсруэ в 1860 г., когда окончательно утвердилось атомно-молекулярное учение, были приняты первые единые определения понятий молекулы и атома, а также атомного веса, который мы теперь называем относительной атомной массой (Аr). Именно это понятие как неизменную характеристику атомов химических элементов Д. И. Менделеев положил в основу своей классификации. Он писал: «Масса вещества есть именно такое свойство его, от которого должны находиться в зависимости все остальные свойства. Поэтому ближе или естественнее всего искать зависимость между свойствами и сходствами элементов, с одной стороны, и атомными их весами — с другой».
Предшественники Д. И. Менделеева сравнивали между собой только сходные элементы, а поэтому и не смогли открыть Периодический закон. В отличие от них, Д. И. Менделеев обнаружил периодичность в изменении свойств химических элементов, расположенных в порядке возрастания величин их атомных масс, сравнивая между собой все известные ему, в том числе и несходные, элементы.
Д. И. Менделеев в своем открытии опирался на четко сформулированные исходные положения:
- общее неизменное свойство атомов всех химических элементов — их атомная масса;
- свойства химических элементов зависят от их атомных масс;
- форма этой зависимости — периодическая.
Рассмотренные выше предпосылки можно назвать объективными, т. е. не зависящими от личности ученого, так как они были обусловлены историческим развитием химии как науки.
Но без личностных качеств великого химика, которые составляют четвертую, субъективную предпосылку открытия Периодического закона, вряд ли он был бы открыт в 1869 г. Если бы его открыл какой-нибудь другой химик, вероятно, это произошло бы намного позже. Энциклопедичность знаний, научная интуиция, умение обобщать, постоянное стремление к познанию неведомого, дар научного предвидения Д. И. Менделеева сыграли свою немалую роль в открытии Периодического закона.
Значение Периодического закона и Периодической системы Д. И. Менделеева
Периодический закон и Периодическая система Д. И. Менделеева являют собой триумф российской химической науки. Подумайте сами, ведь все учёные, которые занимались поиском естественной классификации химических элементов, находились в равных условиях, имели одни и те же научные предпосылки для обобщения. Почему же ни одному из них, кроме Д. И. Менделеева, не удалось открыть Периодический закон?
Очевидно, объективных предпосылок (накопленного фактологического материала, работ предшественников, участия в съезде химиков в г. Карлсруэ, на котором победили идеи атомистики) было мало. Потребовался субъективный, личностный фактор, который у каждого из учёных разный. Д. И. Менделеев имел энциклопедические знания, умел обобщать факты и выдвигать на их основе гипотезы. Очевидно, справедливы слова русского химика Л. А. Чугаева, сказанные им о Д. И. Менделееве: «Гениальный химик, первоклассный физик, плодотворный исследователь в области гидродинамики, метеорологии, геологии, в различных отделах химической технологии (взрывчатые вещества, нефть, учение о топливе) и других сопредельных с химией и физикой дисциплинах, глубокий знаток химической промышленности и промышленности вообще, особенно русской, оригинальный мыслитель в области учения о народном хозяйстве, государственный ум, которому, к сожалению, не суждено было стать государственным человеком, но который видел и понимал задачи и будущность России лучше представителей нашей официальной власти…
Он умел быть философом в химии, в физике и других отраслях естествознания, которых ему приходилось касаться, и естествоиспытателем в проблемах философии, политической экономии и социологии».
Поэтому остаётся только недоумевать, почему Нобелевский комитет, который в 1906 г. в Стокгольме из двух кандидатур — француза А. Муассана и русского Д. И. Менделеева — отдал предпочтение французскому химику. Очевидно, немалую роль в этом решении Нобелевского комитета сыграл тот факт, что кандидатуру А. Муассана выдвинула Французская академия наук, а Д. И. Менделеева — Академия наук Германии. Стыдно признать, что Д. И. Менделеев, будучи почётным членом почти всех европейских академий наук, так и не был избран членом Российской академии, хотя баллотировался в неё не раз.
Очевидно, закономерно и следующее нелогичное поведение Лондонского королевского общества, которое в 1882 г. присудило Д. И. Менделееву медаль Дэви (предшественник и аналог медали нобелевского лауреата) «За открытие периодических соотношений атомных весов», а пятью годами позже, в 1887 г., это же общество вручило такую же медаль своему соотечественнику Дж. Ньюлендсу «За открытие периодического закона химических элементов».
Как признание заслуг русского химика перед мировой наукой следует отметить следующий факт.
В 1955 г. группа американских химиков во главе с Г. Сиборгом получила новый, 101-й элемент, которому в честь величайшего русского химика Д. И. Менделеева единодушно присвоила название «менделевий».
Периодический закон и Периодическая система Д. И. Менделеева позволили:
1) установить взаимосвязь между элементами и объединить их по свойствам;
2) расположить элементы в естественной последовательности;
3) обнаружить периодичность, т. е. повторяемость, свойств элементов и их соединений и объяснить причину этого;
4) исправить и уточнить значения относительных атомных масс некоторых элементов;
5) исправить и уточнить степени окисления (валентность) некоторых элементов;
6) предсказать существование ещё не открытых элементов, описать их свойства, указать пути их открытия.
Триумфом Периодического закона и Периодической системы явилось открытие трёх предсказанных Д. И. Менделеевым элементов — галлия, скандия и германия. Это позволило одному из известных философов назвать открытие Д. И. Менделеевым Периодического закона научным подвигом, подобным подвигу астронома Леверье, предсказавшего орбиту ещё неизвестной планеты Нептун. Почему так эмоционально характеризуется предсказание русского химика? Это связано с открытием первого из предсказанных Д. И. Менделеевым элемента галлия, который был открыт французом П. Э. Лекоком де Буабодраном. Д. И. Менделеев, владевший французским языком, прочитал статью об открытии галлия, а затем написал письмо первооткрывателю этого элемента и указал не только на ошибку П. Э. Лекока де Буабодрана (тот определил неверно плотность галлия), но и назвал причину этой ошибки (образец галлия был недостаточно очищен).
О приоритете в открытии периодического закона
Подтверждение и всеобщее признание периодического закона вызвали в некоторых странах попытки оспаривать приоритет Д. И. Менделеева в этом открытии. Во Франции открытие закона периодичности приписывали де Шанкуртуа, в Англии — Одлингу и Ньюлендсу, в Германии — Л. Мейеру. О своих претензиях заявляли также Бломстранд и Баумгауер.
В связи с этим Менделеев в двух своих статьях показал необоснованность такого рода претензий и привел убедительные доказательства того, что приоритет открытия периодического закона принадлежит русской химической науке. Возникшие споры, продолжавшиеся в течение многих лет (отзвуки которых слышатся иногда и в настоящее время), закончились тем, что большинство ученых во всех странах признало правоту и приоритет Д. И. Менделеева. Даже наиболее настойчивый претендент Л. Мейер в конце концов вынужден был признать:
«В 1869 году, раньше, чем я высказал свои мысли о периодичности свойств элементов, появился реферат статьи Менделеева, в которой написано: 1) при расположении элементов в порядке восходящих атомных весов наблюдается ступенчатое (в оригинале Менделеева — периодическое — В. С.) изменение свойств элементов; 2) величина атомных весов определяет свойства элементов; 3) атомные веса некоторых элементов требуют исправления; 4) должны существовать некоторые еще неоткрытые элементы… Это все было Менделеевым опубликовано до меня и вообще впервые. Я открыто сознаюсь, что у меня не хватило смелости для таких дальновидных предположений, какие с уверенностью высказал Менделеев».
Известные ученые П. Вальден и Аббег заслугу открытия периодического закона признавали только за Менделеевым. Выдающийся русский химик Н. Н. Бекетов в речи на I Менделеевском съезде (1909 г.) о значении работ и открытия Менделеева сказал:
«Это предсказание некоторые ученые сравнивают с открытием Леверрье…, открытие Леверрье есть не только его слава, но, главным образом, слава совершенства самой астрономии, ее основных законов и совершенства тех математических приемов, которые присущи астрономам. Но здесь, в химии, не существовало того закона, который позволял бы предсказывать существование того или другого вещества… Этот закон был открыт и блестяще разработан, самим Д. И. Менделеевым».
Л. А. Чугаев писал:
«Система элементов имеет не только педагогическое значение, является не одним только средством, облегчающим запоминание разнообразных, систематически расположенных и связанных между собой фактов, но имеет также и научное значение, ибо открывает новые аналогии и тем самым намечает пути для познания элементов».
Английский ученый Торп говорил:
«Ни один русский не оказал более важного, более длительного влияния на развитие физических знаний, чем Менделеев. Способ работы и мышление у него настолько самобытны, его метод преподавания и чтения лекций так оригинален, а успех великого обобщения, с которым связано его имя и слава, так поразительно полон, что в глазах ученого мира Европы и Америки он стал для России тем же, чем был Берцелиус для Швеции, Либих для Германии, Дюма для Франции»
Подобных высказываний можно было бы привести очень много, но в этом нет надобности. Честь открытия периодического закона, называемого именем Менделеева, принадлежит Дмитрию Ивановичу Менделееву и это нашло признание во всем мире. Исчерпывающую оценку периодического закона дал Пакет на заседании немецкого научного общества в 1930 г.:
«Самым крупным завоеванием естествознания в XIX веке надо считать открытие периодического закона».
Задания
1. На какой характеристике химических элементов Д.И. Менделеев основывал периодическую систему?
- валентность;
- относительная атомная масса;
- распространенность в природе.
2. На какой характеристике химических элементов основывается современная периодическая система?
- атомный радиус;
- относительная атомная масса;
- порядковый номер.
3. Чем обусловлено деление химических элементов на периоды?
- различным числом валентных электронов;
- различным числом электронных энергетических уровней;
- различным количеством нейтронов в ядре.
4. Назовите элемент с наибольшим атомным радиусом:
- фтор;
- кремний;
- стронций;
- рубидий.
5. В какой из последовательностей элементы расставлены в порядке уменьшения атомного радиуса?
- водород, сера, кальций;
- цинк, углерод, азот;
- кислород, кремний, титан;
- литий, гелий, водород.
6. В какой из последовательностей элементы перечислены в порядке усиления металлических свойств?
- галлий, алюминий, бор;
- сурьма, германий, кремний;
- алюминий, стронций, цезий;
- рубидий, кальций, бериллий.
7. Кислотные свойства оксидов усиливаются в ряду:
- CO2 – CaO – K2O;
- N2O5 – P2O5 – SiO2;
- PbO2 – GeO2 – CO2;
- MgO – Al2O3 – SO3.
8. Основные свойства гидроксидов усиливаются в ряду:
- Mg(OH)2 – Ca(OH)2 – RbOH;
- LiOH – NaOH – Ca(OH)2;
- Ca(OH)2 – Zn(OH)2 – Sr(OH)2;
- LiOH – Mg(OH)2 – Al(OH)3.
9. В ряду химических элементов O – S – Se – Te
- усиливаются неметаллические свойства;
- убывает радиус атома;
- растет количество электронных слоев;
- растет число валентных электронов.
Ответы
- б) относительная атомная масса.
- в) порядковый номер.
- б) различным числом электронных энергетических уровней.
- г) рубидий.
- б) цинк, углерод, азот.
- в) алюминий, стронций, цезий.
- г) MgO – Al2O3 – SO3.
- а) Mg(OH)2 – Ca(OH)2 – RbOH.
- в) возрастает количество электронных слоев.
И одна легенда…

Коллега и друг Д. И. Менделеева, выдающийся русский геолог А. А. Иностранцев (1843–1919), в своих «Воспоминаниях» приводит такой эпизод:
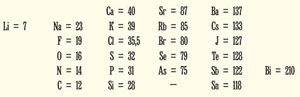
Почему этот рассказ Иностранцева вызывает сомнения? Во-первых, мемуарист работал над своими воспоминаниями в 1919 г., на 76-м году жизни, т. е. спустя полвека после описываемых им событий
Во-вторых, и это более важно, Менделеев, любивший рассказывать окружающим различные забавные и поучительные истории из своей жизни (были и небылицы), ни разу не упоминал об этом чудесном сне. В-третьих, дошедшие до нас наброски будущей системы элементов не позволяют выявить эффект внезапного озарения
На самом трудном, пиковом этапе создания «Опыта», когда Менделеев коренным образом изменил сам принцип построения системы элементов (суть закона — периодический характер изменения свойств элементов по мере возрастания их весов — к этому времени уже была ему ясна, и речь шла об адекватном графическом представлении идеи периодичности), ученый создал промежуточный вариант системы, от которого отталкивался в последующей работе и который в главной своей части практически совпал с таблицей Л. Мейера, впервые опубликованной в 1864 г. в монографии , переведенной на русский язык в 1866 г.

Есть еще один момент, связанный с рассказом Иностранцева и вызывающий вопросы: о массе «перепорченной бумаги». Менделеев имел привычку хранить все, что написал, каждую мелочь, и свой архив он систематизировал сам. Но почему-то из всего, что имело отношение к истории создания «Опыта», им было сохранено только пять рукописных листков.
Разумеется, число загадок, связанных с открытием и сущностью периодического закона, много больше, но рассказ о них выходит за рамки журнальной публикации.
Литература . Менделеев Д. И. Периодический закон. Основные статьи. Редакция, статьи и примечания Б. М. Кедрова. М., 1958.. Newlands J. The Law of Octaves, and the Causes of the Numerical Relations among the AtomicWeights // Chemical News. 1866; 13: 113.. Менделеев Д. И. Органическая химия. Менделеев Д. И. Соч. Т. 8. Л.; М., 1948; 35–602.. Менделеев Д. И. Лекции по общей химии. Менделеев Д. И. Соч.: В 25 т. Л.; М. (1934–1954). 1949; 15: С. 357–439. . Менделеев Д. И. Избранные лекции по химии. М., 1968. . Менделеев Д. И. Периодическая законность химических элементов (1871). Менделеев Д. И. Периодический закон. Основные статьи. Ред. Б. М. Кедров. М., 1958; 102–176.. Менделеев Д. И. Основы химии. СПб., 1906. . Менделеев Д. И. Основы химии. Часть II. Менделеев Д. И. Соч.: В 25 т. Л.-М. (1934–1954). 1949; 14.. Менделеев Д. И. Периодический закон. Дополнительные материалы. Ред. Б. М. Кедров. М., 1960. . Менделеев Д. И. Периодическая законность химических элементов (1898). Менделеев Д. И. Периодический закон. Основные статьи. Ред. Б. М. Кедров. М., 1958; 237–273.. Научное наследство. Естественнонаучная серия. Т. 4. Письма русских химиков к А. М. Бутлерову. М., 1961.. Meyer L. Die Natur der chemischen Elemente als Function ihrer Atomgewichte. Annalen der Chemie und Pharmacie. VII. Supplementband. 1870. S. 354–364.. Научный архив Менделеева, СПбГУ. I-B-23-I-62, 68.. Менделеев Д. И. Попытка химического понимания мирового эфира. Менделеев Д. И. Периодический закон. Основные статьи. Ред. Б. М. Кедров. М., 1958; 470–517.. Добротин Р. Б., Карпило Н. Г., Керова Л. С., Трифонов Д. Н. Летопись жизни и деятельности Д. И. Менделеева. Отв. ред. А. В. Сторонкин. Л., 1984.. Тищенко В. Е., Младенцев М. Н. Дмитрий Иванович Менделеев, его жизнь и деятельность. Университетский период, 1861–1890 гг. Отв. ред. Ю. И. Соловьев. М., 1993.. Иностранцев А. А. Воспоминания. Подготовка текста, вступительная статья и комментарии В. А. Прозоровского и И. Л. Тихонова. СПб., 1998.. Meyer L. Die Modernen Theorien der Chemie und Ihre Bedeutung für die chemische Statik. Breslau, 1864.
В настоящее время принято выражение «атомная масса», но я буду придерживаться исторической терминологии.
Далее даты, если не оговорено, приводятся по старому стилю, для перевода в новый стиль следует прибавить 12 дней.
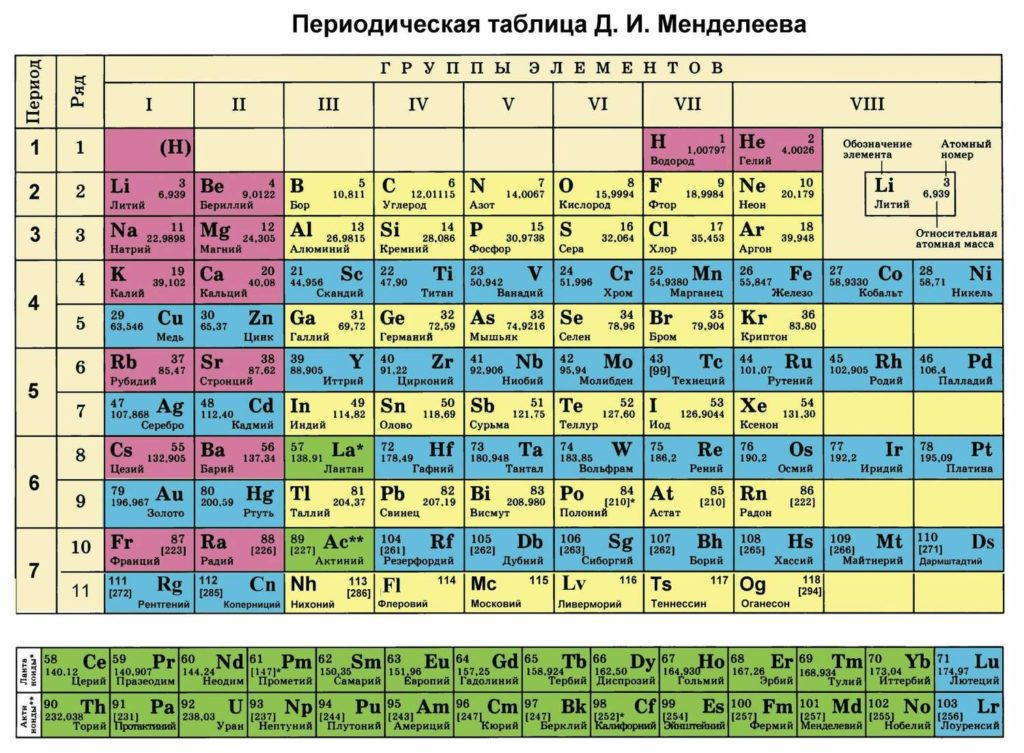
Организация периодической таблицы
Из элементов-аналогов сформировано 8 групп – столбцов. Горизонтальные последовательности, в пределах которых меняются свойства, – периоды.
Смысл периодов
Период открывается щелочным металлом (один электрон на внешнем уровне) и закрывается инертным газом, у которого уровень заполнен целиком. В рамках периода свойства меняются монотонно, но число электронных слоев (номер периода) остается неизменным, и энергии валентных электронов имеют близкие значения.
- Периоды с первого по третий – малые. Они имеют в составе 2 (1-й) или 8 (2-й и 3-й) элементов, у которых заполняются исключительно внешние оболочки атомов.
- Большие периоды, разделенные на ряды, содержат по 18 (4-й и 5-й) или по 32 (6-й и 7-й) элементов. Их электронные конфигурации сложнее, и у элементов, называемых переходными, заполняются внутренние оболочки.
Группы и подгруппы
Общность элементов в группе обусловлено одинаковым заполнением внешнего слоя. Оно выражается номером группы.
Размещенные на одной вертикали элементы разных рядов периода (например, кальций и цинк) формируют подгруппы.
У атомов элементов главных подгрупп лишь внешние оболочки располагают валентными электронами. Переходные элементы входят в побочные подгруппы. Им свойственны непостоянные степени окисления и проявление как основных, так и кислотных свойств.
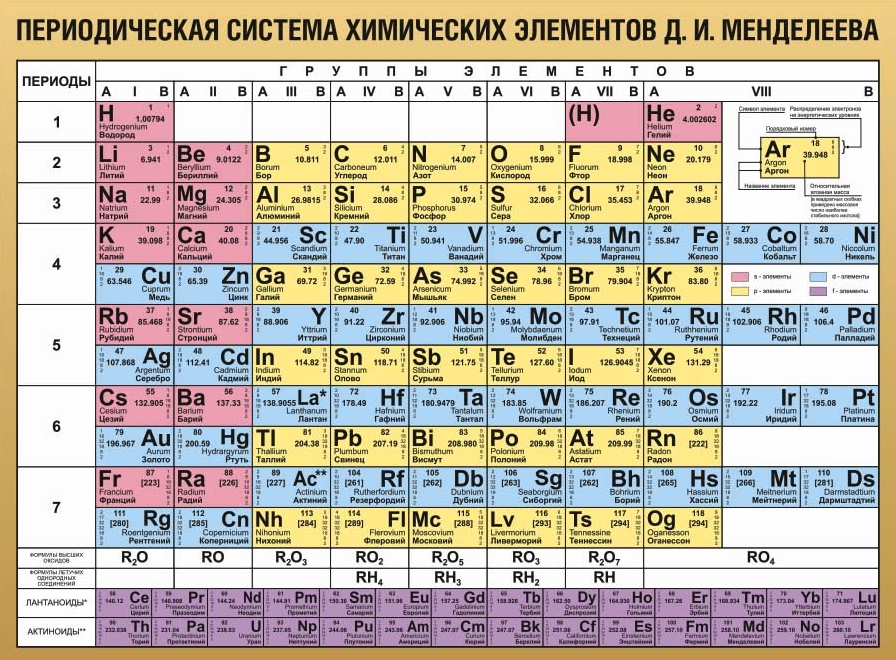
Ячейка таблицы
Позицию элемента в системе характеризует:
- символ;
- порядковый номер;
- название;
- относительная атомная масса.
В ячейку может также включаться информация об электронной конфигурации.
Варианты таблицы
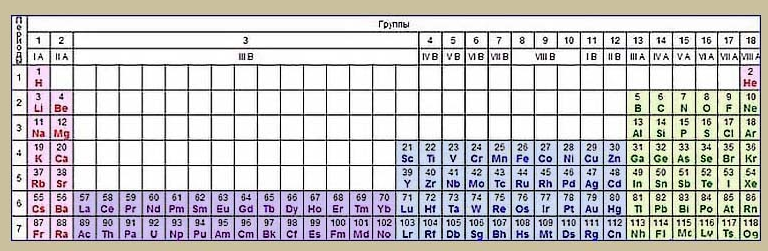
Разработано несколько версий таблицы периодической системы элементов. Помимо рассмотренной выше классической, или короткой формы, распространены два варианта:
- Длинная таблица построена из 18 групп. Каждая строка представляет один период. Переходные элементы образуют особый блок (группы 3 – 12). Семейства лантаноидов и актиноидов по-прежнему выведены за рамки таблицы.
- Сверхдлинная таблица содержит все элементы в полностью развернутых периодах.
Длинная форма утверждена в качестве основной. Классическая версия признана устаревшей, но используется и сейчас.
Периодический закон и его значение
В 1871 году великим русским учёным, наконец, был окончательно сформулирован Периодический закон, который совершенствовался ещё в течение нескольких лет.

Открытый Менделеевым закон и составленная по нему таблица оказала большое влияние на дальнейшее развитие химии. Периодическая таблица стала естественным, а не математическим воплощением того, как тесно связаны межу собой все химические элементы. Также благодаря открытию Дмитрия Ивановича учёного удалось не только предвидеть обнаружение ещё нескольких новых веществ, но и предсказать их свойства.
В течение следующих 15 лет на основании таблицы и полученных учёными данных были проведены поиски этих элементов, которые завершились триумфом Менделеева
Были найдены Галлий (Ga), Скандий (Sc), Германий (Ge), что только ещё раз подтвердило всю важность и значимость открытия Дмитрия Ивановича Менделеева
Российская империя
- Список императоров России по порядку и годы их правления
- Территории, входившие в состав Российской империи
- Деятельность Госдумы 1906-1917 гг.
- Табель о рангах. Главное
- Первая всеобщая перепись Российской империи
- Революция 1905-1907 гг.: причины, цели, итоги
- Россия в Первой мировой. Самое главное
- Коротко об эпохе дворцовых переворотов
- История герба России
ЕГЭ по истории
- Кодификатор ЕГЭ с объяснением всех тем
- Перевод первичных баллов ЕГЭ во вторичные. Шкала баллов по заданиям
- Правители от Рюрика до Путина
- Даты всемирной истории для ЕГЭ
- Краткая характеристика всех периодов русской истории
- Демоверсия ЕГЭ с ответами
ОГЭ по истории
- Кодификатор ОГЭ с объяснением всех тем
- Перевод баллов ОГЭ в оценку
- Демоверсия ОГЭ с ответами
- Даты всемирной истории для ОГЭ
Выбери ответ
По вертикали и по горизонтали
Суть периодического закона, открытого Менделеевым, заключается в том, что свойства элементов зависят от их атомной массы. При этом меняются они не монотонно, а периодически. Что это означает? Если расположить элементы по возрастанию атомной массы, то через определенное количество элементов свойства начинают повторяться. К примеру, фтор похож на хлор, а натрий — на калий. В таблице они расположены друг под другом, в разных рядах, но в одних и тех же колонках.
Таким образом, в каждом ряду периодической таблицы происходит постепенное возрастание массы элементов. А в каждой колонке собраны элементы со схожими химическими свойствами. К примеру, с правого края таблицы находится колонка, содержащая так называемые благородные газы: гелий, неон, аргон, криптон, ксенон и радон. Это вещества, известные своей низкой химической активностью — они неохотно вступают в реакции с другими элементами. Вещества из крайней левой колонки (литий, натрий и т. д.) обладают противоположными качествами — во взаимодействиях они проявляют себя очень бурно.
Составляя таблицу, Менделеев обнаружил, что некоторые элементы в нее не вписываются, и, чтобы они заняли свои места, нужно изменить их атомную массу. Он так и сделал. Самое поразительное — впоследствии было обнаружено, что «приписанная» атомная масса оказалась правильной! Это стало одним из доказательств того, что ученый открыл фундаментальный закон природы. Вторым доказательством послужило открытие многочисленных новых элементов, которые были предсказаны Менделеевым и идеально вписались в таблицу.
Поделиться ссылкой