Оглавление
Уроки творческого процесса
Говоря о том, какие уроки творческого процесса можно извлечь из всей истории создания периодической таблицы Д. И. Менделеева, можно привести в пример идеи английского исследователя в области творческого мышления Грэма Уоллеса и французского учёного Анри Пуанкаре. Приведём их вкратце.
Согласно исследованиям Пуанкаре (1908 год) и Грэма Уоллеса (1926 год), существует четыре основных стадии творческого мышления:
- Подготовка – этап формулирования основной задачи и первые попытки её решения;
- Инкубация – этап, во время которого происходит временное отвлечение от процесса, но работа над поиском решения задачи ведётся на подсознательном уровне;
- Озарение – этап, на котором находится интуитивное решение. Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;
- Проверка – этап испытаний и реализации решения, на котором происходит проверка этого решения и его возможное дальнейшее развитие.
Как мы видим, в процессе создания своей таблицы Менделеев интуитивно следовал именно этим четырём этапам. Насколько это эффективно, можно судить по результатам, т.е. по тому, что таблица была создана. А учитывая, что её создание стало огромным шагом вперёд не только для химической науки, но и для всего человечества, приведённые выше четыре этапа могут быть применимы как к реализации небольших проектов, так и к осуществлению глобальных замыслов. Главное помнить, что ни одно открытие, ни одно решение задачи не могут быть найдены сами по себе, как бы ни хотели мы увидеть их во сне и сколько бы ни спали
Чтобы что-то получилось, не важно, создание это таблицы химических элементов или разработка нового маркетинг-плана, нужно обладать определёнными знаниями и навыками, а также умело использовать свои потенциал и упорно работать
Мы желаем вам успехов в ваших начинаниях и успешной реализации задуманного!
«Периодическая система химических элементов»
Ключевые слова конспекта: Периодическая система химических элементов Д.И. Менделеева, группы и периоды Периодической системы, физический смысл порядкового номера химического элемента.
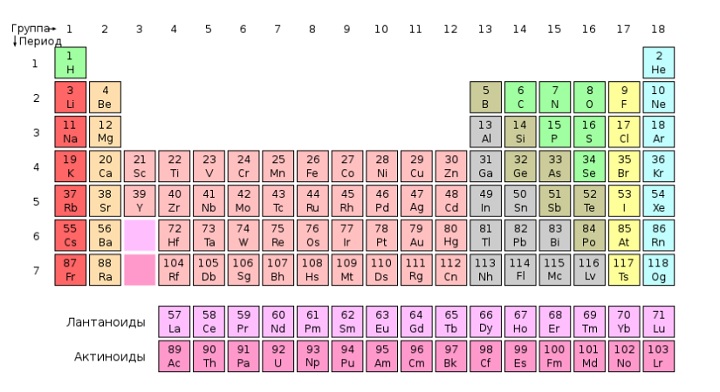
Периодическая система химических элементов — это таблица, в которой все химические элементы расположены в порядке возрастания атомных номеров. Таблица включает в себя периоды и группы, т.е. горизонтальные строчки и вертикальные столбцы.
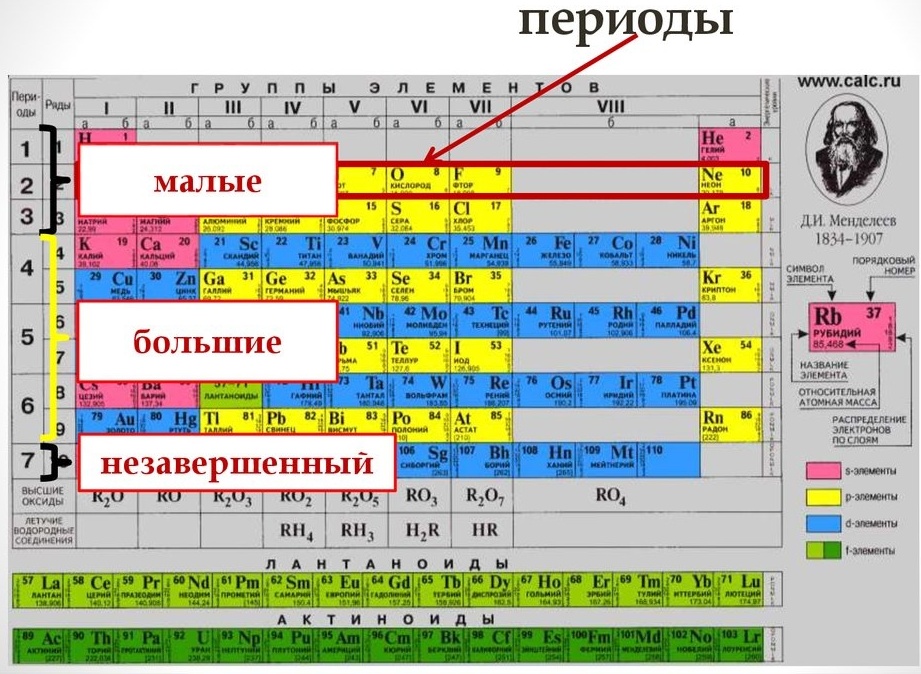
Период — это последовательность (горизонтальный ряд в таблице) элементов с возрастающими атомными номерами, начинающаяся щелочным металлом (или водородом) и заканчивающаяся благородным газом.
Число электронных слоев в атомах данного периода равно номеру периода.
В периодах с возрастанием атомного номера Z металлические свойства ослабевают, а неметаллические усиливаются.
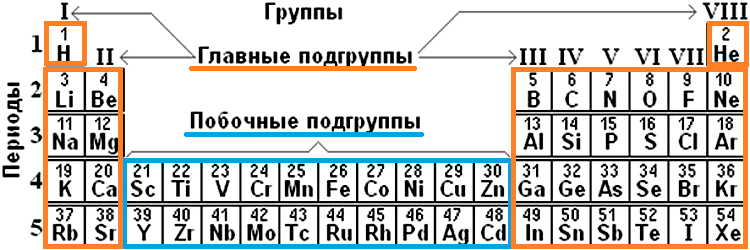
Группа — это вертикальная колонка элементов в таблице, включающая элементы с одинаковой максимальной степенью окисления, равной номеру группы, и одинаковой отрицательной степенью окисления, для атомов неметаллов равной номеру группы минус 8.
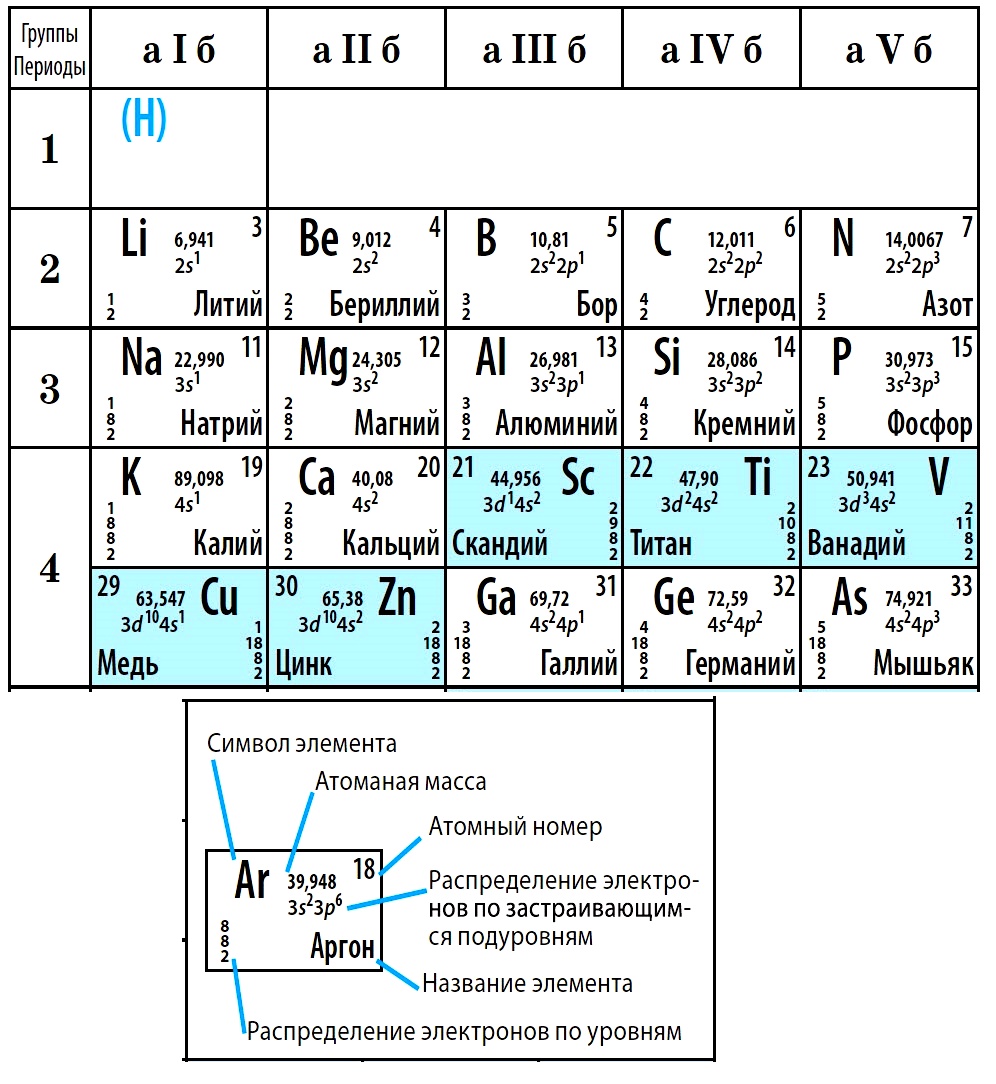
В группах с возрастанием атомного номера Z металлические свойства усиливаются, а неметаллические ослабевают. Число валентных электронов атома обычно равно номеру группы.
В коротком варианте таблицы Менделеева различают малые периоды — 1-й, 2-й и 3-й, содержащие 2, 8 и 8 элементов соответственно, а также большие периоды — 4-й, 5-й, 6-й и незавершенный 7-й. Каждый большой период таблицы включает две строчки (два ряда). Например, в 4-м периоде, начинающемся калием 19K, последний элемент в верхней строчке — никель 28Ni, он в числе элементов триады (Fe, Со, Ni) попадает в VIII группу. Следующий элемент — медь 29Cu записан строчкой ниже и находится в I-й группе.
Каждая группа с номерами от I до VIII включает две группы — А и Б.
A-группы включают элементы малых периодов, а также элементы больших периодов, которые по свойствам наиболее близки к соответствующим элементам малых периодов.
Б-группы включают элементы больших периодов, в атомах которых электроны, появляющиеся в них с увеличением заряда ядра, попадают в слой, предшествующий внешнему.
Физический смысл порядкового номера химического элемента:
- это число нейтронов в атоме;
- это относительная атомная масса;
- это число энергетических уровней в атоме;
- это число протонов в ядре.

Конспект урока «Периодическая система химических элементов».
Следующая тема: «Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе».
Таблицы Одлинга и Мейера
В 1864 году увидела свет еще одна таблица, в которой элементы располагались согласно их атомным весам и сходству химических свойств. Однако никакого описания к ней не было. В это же время появилась и другая таблица Мейера. В нее было включено 28 элементов, расположенных согласно их валентности.
В 1870 году вышла еще одна таблица Мейера которая насчитывала 9 вертикальных столбцов. Элементы с похожими свойствами были расположены в горизонтальных рядах, а некоторые ячейки так и остались пустыми. Таблица сопровождалась графиком зависимости объема атома от его веса, который имел пилообразный вид и указывал на периодичность, правда, это произошло уже после того, как Менделеев открыл таблицу химических элементов.
Организация периодической системы
Химические элементы в таблице Д. И. Менделеева расположены по рядам, в соответствии с возрастанием их массы, а длина рядов подобрана так, чтобы находящиеся в них элементы имели схожие свойства. Например, благородные газы, такие как радон, ксенон, криптон, аргон, неон и гелий с трудом вступают в реакции с другими элементами, а также имеют низкую химическую активность, из-за чего расположены в крайнем правом столбце. А элементы левого столбца (калий, натрий, литий и т.д.) отлично реагируют с прочими элементами, а сами реакции носят взрывной характер. Говоря проще, внутри каждого столбца элементы имеют подобные свойства, варьирующиеся при переходе от одного столбца к другому. Все элементы, вплоть до №92 встречаются в природе, а с №93 начинаются искусственные элементы, которые могут быть созданы лишь в лабораторных условиях.
В своём первоначальном варианте периодическая система понималась только как отражение существующего в природе порядка, и никаких объяснений, почему всё должно обстоять именно так, не было. И лишь когда появилась квантовая механика, истинный смысл порядка элементов в таблице стал понятен.
ХИМИЯ
§ 5.1. Предпосылки открытия Периодического закона Д. И. Менделеевым
Периодический закон и Периодическая система химических элементов Д. И. Менделеева — основа современной химии. Они относятся к таким научным закономерностям, которые отражают явления, реально существующие в природе, и поэтому никогда не потеряют своего значения.
Их открытие было подготовлено ходом истории развития химии, однако потребовалась гениальность Д. И. Менделеева, его дар научного предвидения, чтобы эти закономерности были сформулированы и графически представлены в виде таблицы. Мы будем пользоваться современными синонимами тех терминов, которые применял великий русский химик.
Ко времени открытия Периодического закона было известно 63 химических элемента, описаны состав и свойства их многочисленных соединений.
Ученые неоднократно предпринимали попытки классифицировать химические элементы, привести сведения о них в систему. К концу 60-х гг. XIX в. насчитывалось более 50 различных вариантов классификации химических элементов (среди них: классификация Берцелиуса на металлы и неметаллы, триады Деберейнера, спираль Шанкуртуа, октавы Ньюлендса, таблица Мейера и др.).
Большинство ученых пытались выявить связь между химическими свойствами элементов и их соединений и атомной массой. Но создать классификацию, включающую все известные в то время химические элементы, не удалось. Ни одна из попыток не привела к созданию системы, отражающей взаимосвязь элементов и выявляющей природу их сходства и различия. Открытие Периодического закона и построение Периодической системы химических элементов — заслуга великого русского ученого Д. И. Менделеева.
В отличие от работ предшественников, предложенная Д. И. Менделеевым таблица Периодической системы химических элементов имела четкую структуру в виде групп и периодов (с рядами), в которой нашлось место не только для всех известных в то время элементов, но были оставлены пустые места для еще не открытых (рис. 8). Система Д. И. Менделеева позволила не только предсказать существование неизвестных элементов, но и предугадать их свойства, исправить неверно определенные атомные массы уже известных элементов.
Рис. 8. Первоначальный вариант Периодической системы, воспроизведенный на здании в Санкт-Петербурге, где работал Д. И. Менделеев
Третьей предпосылкой открытия Периодического закона послужили решения международного съезда химиков в г. Карлсруэ в 1860 г., когда окончательно утвердилось атомно-молекулярное учение, были приняты первые единые определения понятий молекулы и атома, а также атомного веса, который мы теперь называем относительной атомной массой (Аr). Именно это понятие как неизменную характеристику атомов химических элементов Д. И. Менделеев положил в основу своей классификации. Он писал: «Масса вещества есть именно такое свойство его, от которого должны находиться в зависимости все остальные свойства. Поэтому ближе или естественнее всего искать зависимость между свойствами и сходствами элементов, с одной стороны, и атомными их весами — с другой».
Предшественники Д. И. Менделеева сравнивали между собой только сходные элементы, а поэтому и не смогли открыть Периодический закон. В отличие от них, Д. И. Менделеев обнаружил периодичность в изменении свойств химических элементов, расположенных в порядке возрастания величин их атомных масс, сравнивая между собой все известные ему, в том числе и несходные, элементы.
Д. И. Менделеев в своем открытии опирался на четко сформулированные исходные положения:
- общее неизменное свойство атомов всех химических элементов — их атомная масса;
- свойства химических элементов зависят от их атомных масс;
- форма этой зависимости — периодическая.
Рассмотренные выше предпосылки можно назвать объективными, т. е. не зависящими от личности ученого, так как они были обусловлены историческим развитием химии как науки.
Но без личностных качеств великого химика, которые составляют четвертую, субъективную предпосылку открытия Периодического закона, вряд ли он был бы открыт в 1869 г. Если бы его открыл какой-нибудь другой химик, вероятно, это произошло бы намного позже. Энциклопедичность знаний, научная интуиция, умение обобщать, постоянное стремление к познанию неведомого, дар научного предвидения Д. И. Менделеева сыграли свою немалую роль в открытии Периодического закона.
Вспышки сверхновых и дело рук человеческих
Следует упомянуть еще одно явление, важное с точки зрения нуклеосинтеза, — вспышки термоядерных сверхновых. Считается, что эти взрывы (в отличие от сверхновых с коллапсом ядра) происходят не на одиночных массивных звездах, а в двойных системах, в которых по крайней мере один из компонентов — белый карлик
Как уже говорилось, белый карлик представляет собой компактный остаток звезды малой или промежуточной массы. Он удерживается от коллапса давлением вырожденного электронного газа. Как показывают расчеты, равновесие между гравитацией и давлением в этом случае возможно лишь при условии, что масса карлика не превышает 1,4M☉. Естественно, в момент образования масса белого карлика не превосходит критического значения, однако, если позже она по каким-то причинам увеличится, равновесие будет утрачено и карлик разрушится колоссальным термоядерным взрывом.
Увеличение массы может вызываться как минимум двумя причинами, и обе требуют, чтобы белый карлик был членом двойной системы. Во-первых, он может нарастить массу за счет перетекания на него вещества со второго компонента системы — нормальной звезды, которая все еще проходит завершающие этапы эволюции. Во-вторых, объект с массой больше критической может сформироваться в результате слияния двух белых карликов. В этом случае нужна состоящая из них двойная система. Она так же, как и пара нейтронных звезд, излучает гравитационные волны, что приводит к сближению компонентов. И в том, и в другом случае происходит взрыв, стимулирующий быстрое протекание термоядерных реакций, также заканчивающихся синтезом железа. Однако если в массивной звезде большая часть железа остается в ядре, то при взрыве белого карлика все синтезированные элементы разлетаются по ближайшим галактическим окрестностям. Поэтому главным источником элементов железного пика служат, вероятно, не массивные звезды, а взрывающиеся белые карлики.
Итак, за появление практически всех элементов Периодической таблицы Д. И. Менделеева отвечают различные этапы звездной эволюции, в финале которой эти элементы либо посредством спокойного сброса оболочки звездами промежуточных масс, либо в результате взрыва массивных звезд попадают в межзвездную среду (рис. 8). Из легких элементов нам осталось разобраться только с бериллием и бором. Эти элементы формируются в межзвездной среде в реакциях скалывания, т.е. при разрушении более крупных ядер (преимущественно кислорода и углерода) в результате столкновений с частицами космических лучей. Такие реакции порождают и ядра других элементов, но только для бериллия, бора, а также легкого изотопа лития 6Li они являются основным источником.
Известные нам естественные процессы синтеза атомных ядер заканчиваются, вероятно, плутонием-239, который образуется в урановых рудах в результате захвата нейтрона ядром урана-238 и последующего бета-распада. Нельзя исключить наличия там же нескольких атомов и более тяжелых элементов, однако в целом история природного синтеза значимых количеств атомных ядер заканчивается ураном. Чтобы создать условия для появления еще более массивных атомных ядер, Природе пришлось пойти наиболее замысловатым путем, а именно породить цивилизацию на ничем не примечательной планете у ничем не примечательной звезды.
Литература . Asplund M., Grevesse N., Sauval A. J., Scott P. The Chemical Composition of the Sun // Ann. Rev. Astron. Astrophys. 2009; 47: 481–522. DOI: org/10.1146/annurev.astro.46.060407.145222.. Alpher R. A., Bethe H., Gamow G. The Origin of Chemical Elements // Phys. Rev. 1948; 73: 803.. Cyburt R. H., Fields B. D., Olive K. A., Yeh T.-H. Big bang nucleosynthesis: Present status // Rev. Mod. Phys. 2016; 88(1): 015004-1. DOI: org/10.1103/RevModPhys.88.015004.. Burbidge E. M., Burbidge G. R., Fowler W. A., Hoyle F. Synthesis of the Elements in Stars // Rev. Mod. Phys. 1957; 29: 547.. Käppeler F., Gallino R., Bisterzo S., Aoki W. The s-process: Nuclear physics, stellar models, and observations // Rev. Mod. Phys. 2011; 83(1): 157.. Thielemann F. K., Eichler M., Panov I. V., Wehmeyer B. Neutron Star Mergers and Nucleosynthesis of Heavy Elements // Annu. Rev. Nucl. Part. Sci. 2017; 67(1): 253–274. DOI: 10.1146/annurev-nucl-101916-123246.. Smartt S. J., Chen T.-W., Jerkstrand A. et al. A kilonova as the electromagnetic counterpart to a gravitational-wave source // Nature. 2017; 551: 75. DOI: 10.1038/nature24303.
Фотосфера — видимый слой Солнца, глубиной 200–300 км. — Примеч. ред.
Что ждёт таблицу Менделеева в ближайшем будущем?
 Границы таблицы попытался определить Ричард Фейнман
Границы таблицы попытался определить Ричард Фейнман
Элементы 119 и 120, над получением которых работают исследователи Объединенного института ядерных исследований (ОИЯИ) в Дубне (Московская область), обещают показать принципиально новые физические свойства.
Они которые не вписываются в существующую физическую модель мироздания. А закон Менделеева продолжает работать.
Ричард Фейнман предположил, что таблица закончится на 137-м элементе. Но не потому, что больше их не существует — мы просто не сможем определить количество протонов и нейтронов в его ядре.
 В ближайшие 2 года ожидается открытие 120 элемента
В ближайшие 2 года ожидается открытие 120 элемента
Число 1/137 – постоянная Зоммерфельда (постоянная тонкой структуры), которая описывает вероятность поглощения или излучения электроном фотона.
Элемент с 137 электронами в соответствии с определением этой константы должен с вероятностью в 100% поглощать падающий на него фотон.
Его электроны будут вращаться со скоростью света. А электроны элемента 139, чтобы существовать, должны вращаться быстрее, чем скорость света. Не может быть?
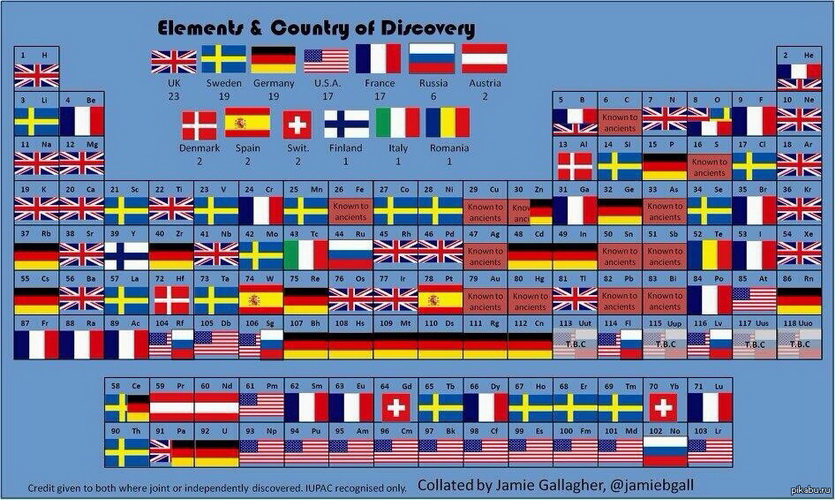 Менделеев объединил усилия всех
Менделеев объединил усилия всех
Увы, текущие расчеты показывают, что фотоны в огромных атомах оганесона должны превысить скорость света, что противоречит самой сути фотона – единичного кванта света.
Это нарушает основные принципы квантовой физики. Но, возможно, именно открытие новых элементов Периодической таблицы Менделеева даст ключ к созданию Теории Всего, которая должна объединить существующие знания в естественных науках.
Закон, открытый 150 лет назад русским ученым, изменит понимание мироздания. Быть может ещё сильнее, чем когда-то это сделала Теория относительности.

iPhones.ru
Интересные факты.
Варианты теорий об элементах
Продолжим разговор о том, когда была открыта периодическая система Менделеева. Во второй половине семнадцатого века выдающимся ученым Робертом Бойлем была опубликована книга, которая полностью разрушила миф алхимиков. Ученому удалось выявить пятнадцать неразложимых химических элементов, которые были известны в то время. В восемнадцатом веке Лавуазье дополнил данный перечень, создал список элементов, в котором было 35 наименований.
К девятнадцатому веку были известны шестьдесят три химических знака, но никому не удавалось построить из них полноценную логическую цепочку. Химик Ньюленд еще до Менделеева хотел расположить их в таблицу, но мировое сообщество не поддержало его идею. Именно ее взял за основу Дмитрий Иванович в своей деятельности.

Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Значение Периодического закона и Периодической системы Д. И. Менделеева
Периодический закон и Периодическая система Д. И. Менделеева являют собой триумф российской химической науки. Подумайте сами, ведь все учёные, которые занимались поиском естественной классификации химических элементов, находились в равных условиях, имели одни и те же научные предпосылки для обобщения. Почему же ни одному из них, кроме Д. И. Менделеева, не удалось открыть Периодический закон?
Очевидно, объективных предпосылок (накопленного фактологического материала, работ предшественников, участия в съезде химиков в г. Карлсруэ, на котором победили идеи атомистики) было мало. Потребовался субъективный, личностный фактор, который у каждого из учёных разный. Д. И. Менделеев имел энциклопедические знания, умел обобщать факты и выдвигать на их основе гипотезы. Очевидно, справедливы слова русского химика Л. А. Чугаева, сказанные им о Д. И. Менделееве: «Гениальный химик, первоклассный физик, плодотворный исследователь в области гидродинамики, метеорологии, геологии, в различных отделах химической технологии (взрывчатые вещества, нефть, учение о топливе) и других сопредельных с химией и физикой дисциплинах, глубокий знаток химической промышленности и промышленности вообще, особенно русской, оригинальный мыслитель в области учения о народном хозяйстве, государственный ум, которому, к сожалению, не суждено было стать государственным человеком, но который видел и понимал задачи и будущность России лучше представителей нашей официальной власти…
Он умел быть философом в химии, в физике и других отраслях естествознания, которых ему приходилось касаться, и естествоиспытателем в проблемах философии, политической экономии и социологии».
Поэтому остаётся только недоумевать, почему Нобелевский комитет, который в 1906 г. в Стокгольме из двух кандидатур — француза А. Муассана и русского Д. И. Менделеева — отдал предпочтение французскому химику. Очевидно, немалую роль в этом решении Нобелевского комитета сыграл тот факт, что кандидатуру А. Муассана выдвинула Французская академия наук, а Д. И. Менделеева — Академия наук Германии. Стыдно признать, что Д. И. Менделеев, будучи почётным членом почти всех европейских академий наук, так и не был избран членом Российской академии, хотя баллотировался в неё не раз.
Очевидно, закономерно и следующее нелогичное поведение Лондонского королевского общества, которое в 1882 г. присудило Д. И. Менделееву медаль Дэви (предшественник и аналог медали нобелевского лауреата) «За открытие периодических соотношений атомных весов», а пятью годами позже, в 1887 г., это же общество вручило такую же медаль своему соотечественнику Дж. Ньюлендсу «За открытие периодического закона химических элементов».
Как признание заслуг русского химика перед мировой наукой следует отметить следующий факт.
В 1955 г. группа американских химиков во главе с Г. Сиборгом получила новый, 101-й элемент, которому в честь величайшего русского химика Д. И. Менделеева единодушно присвоила название «менделевий».
Периодический закон и Периодическая система Д. И. Менделеева позволили:
1) установить взаимосвязь между элементами и объединить их по свойствам;
2) расположить элементы в естественной последовательности;
3) обнаружить периодичность, т. е. повторяемость, свойств элементов и их соединений и объяснить причину этого;
4) исправить и уточнить значения относительных атомных масс некоторых элементов;
5) исправить и уточнить степени окисления (валентность) некоторых элементов;
6) предсказать существование ещё не открытых элементов, описать их свойства, указать пути их открытия.
Триумфом Периодического закона и Периодической системы явилось открытие трёх предсказанных Д. И. Менделеевым элементов — галлия, скандия и германия. Это позволило одному из известных философов назвать открытие Д. И. Менделеевым Периодического закона научным подвигом, подобным подвигу астронома Леверье, предсказавшего орбиту ещё неизвестной планеты Нептун. Почему так эмоционально характеризуется предсказание русского химика? Это связано с открытием первого из предсказанных Д. И. Менделеевым элемента галлия, который был открыт французом П. Э. Лекоком де Буабодраном. Д. И. Менделеев, владевший французским языком, прочитал статью об открытии галлия, а затем написал письмо первооткрывателю этого элемента и указал не только на ошибку П. Э. Лекока де Буабодрана (тот определил неверно плотность галлия), но и назвал причину этой ошибки (образец галлия был недостаточно очищен).
Периодическая таблица: история
К середине XIX века было известно о 63 химических элементах. Химики всего мира боролись над созданием единой концепции, пытались объединить эти элементы в некую систему. Их предлагалось структурировать согласно возрастанию их атомной массы, а также разбить на группы по принципу схожести свойств.
В 1863 году Джон Александр Ньюленд опубликовал свой вариант схемы химических элементов. Однако его работу никто не принял всерьез, так как Ньюленд увлекался поиском связи между музыкой и химией.
В 1869 году Дмитрий Менделеев предложил свою схему периодической таблицы. Позже он ее не раз правил и улучшал, пока она не приняла привычный нам вид.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут
Суть открытия заключается в том, что рост атомной массы элементов влияет на химические свойства не монотонно, а периодически. После некоторого количества разных по свойствам элементов, свойства начинают повторяться. Так, калий схож с натрием, фтор — с хлором, а золото — с серебром и медью.
Через два года Менделеев окончательно объединил свои идеи, создал на их основе закон и предсказал открытие новых элементов. Позже ученые, отрывшие галлий, германий и скандий, подтвердили его догадки.
Определение
В современной формулировке закон звучит следующим образом: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.